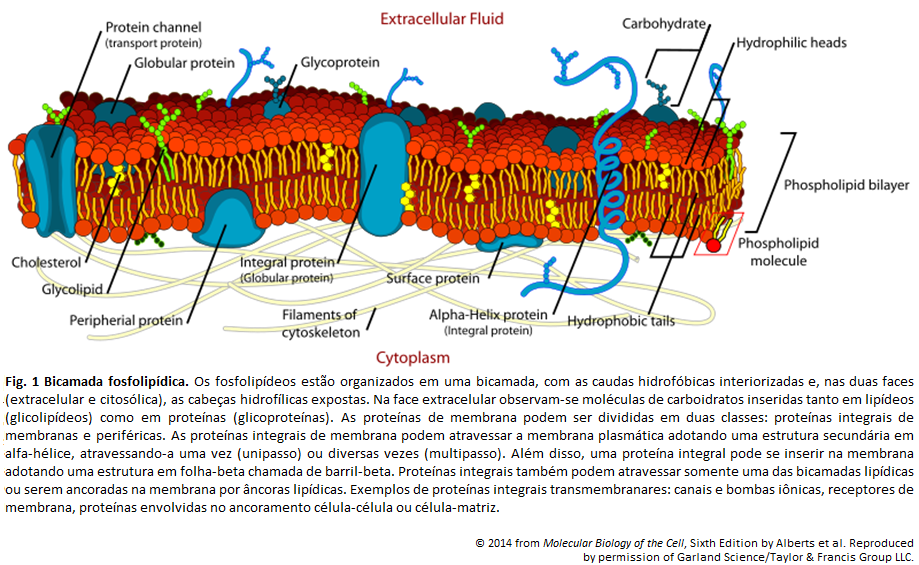
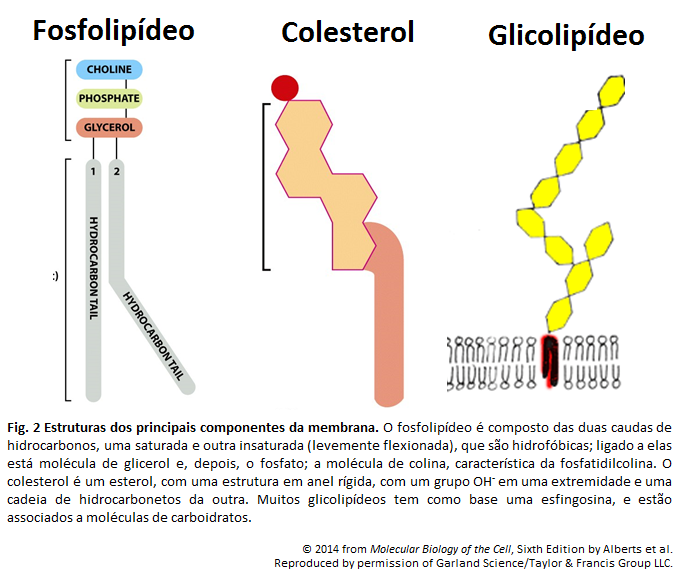
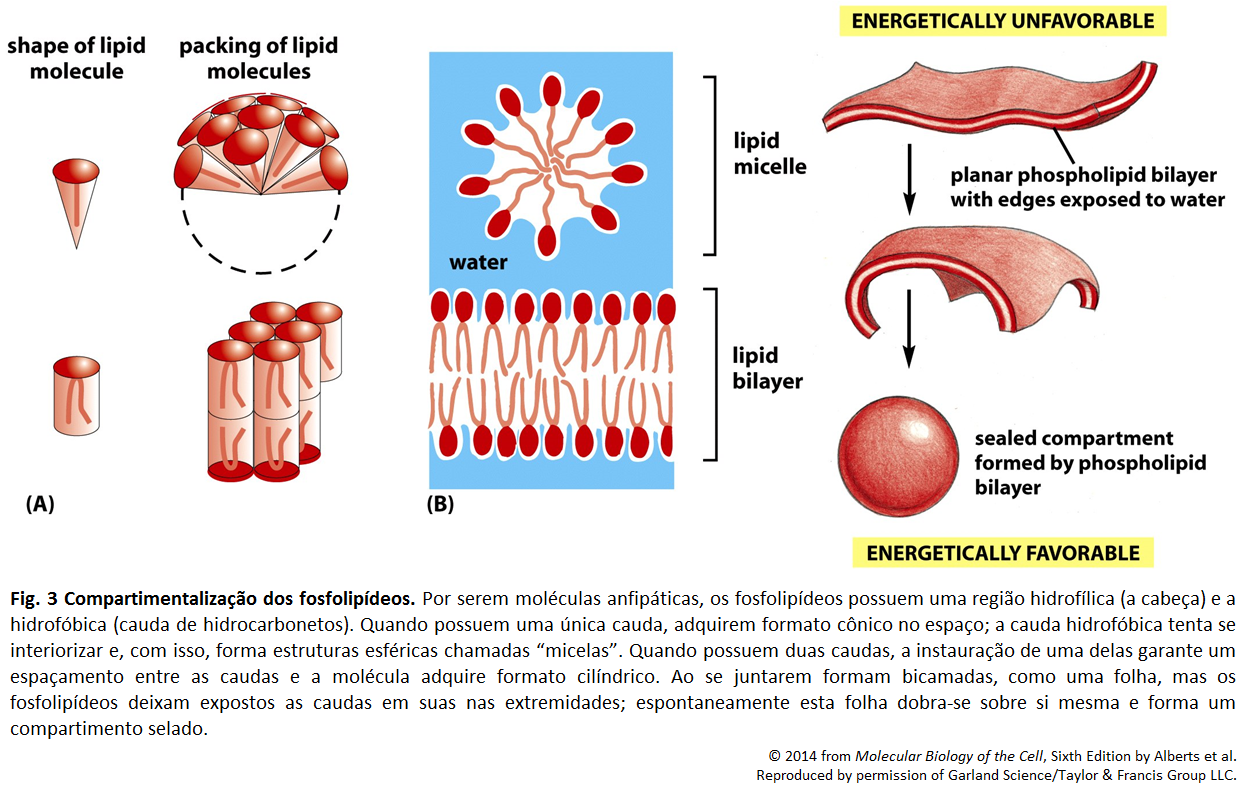
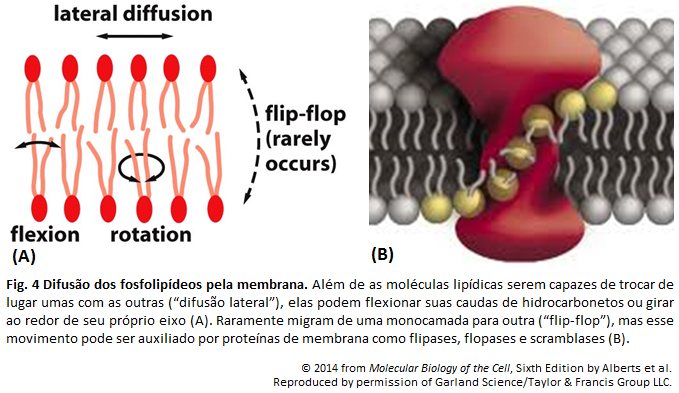
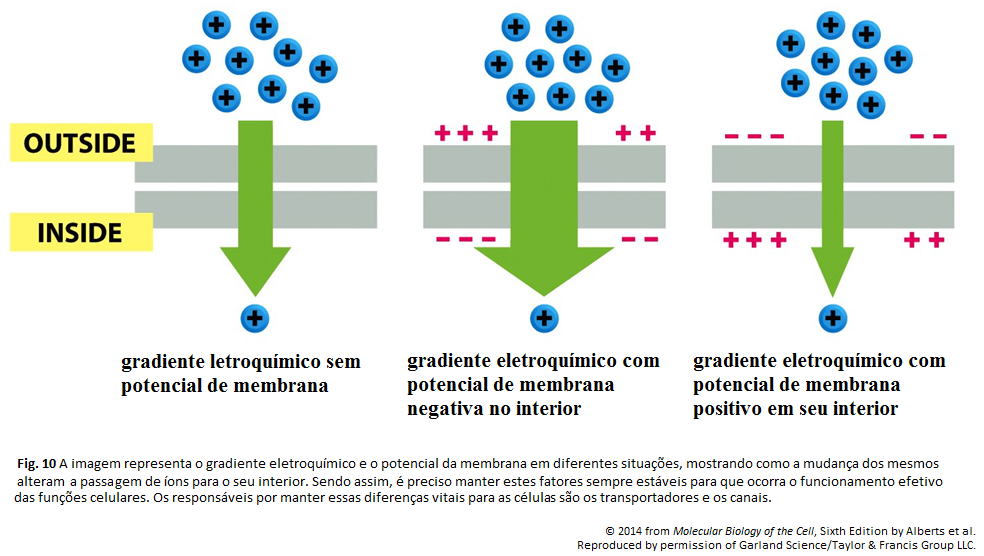
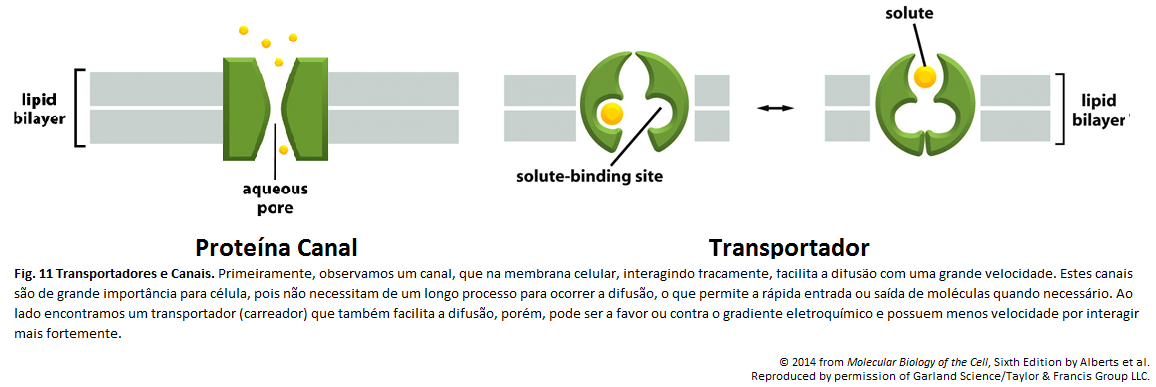
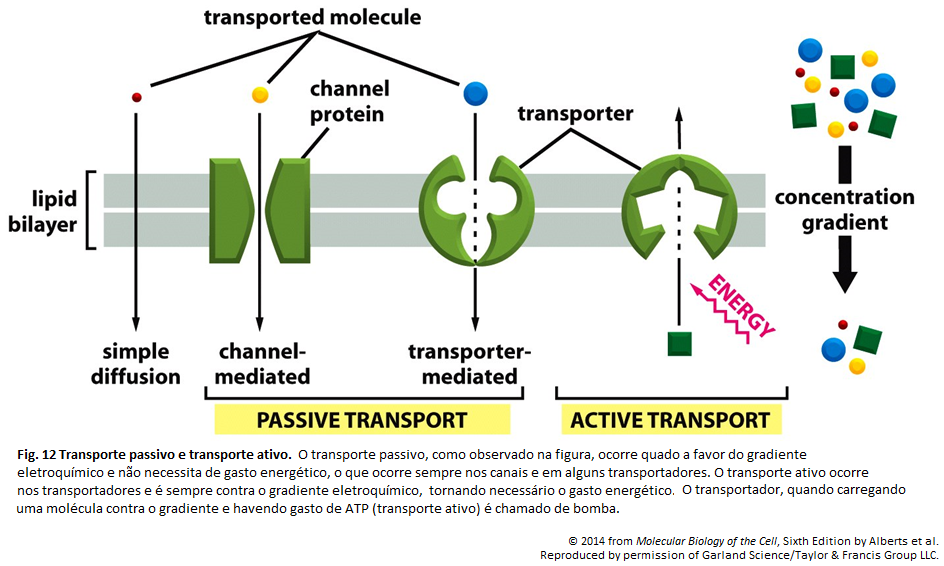
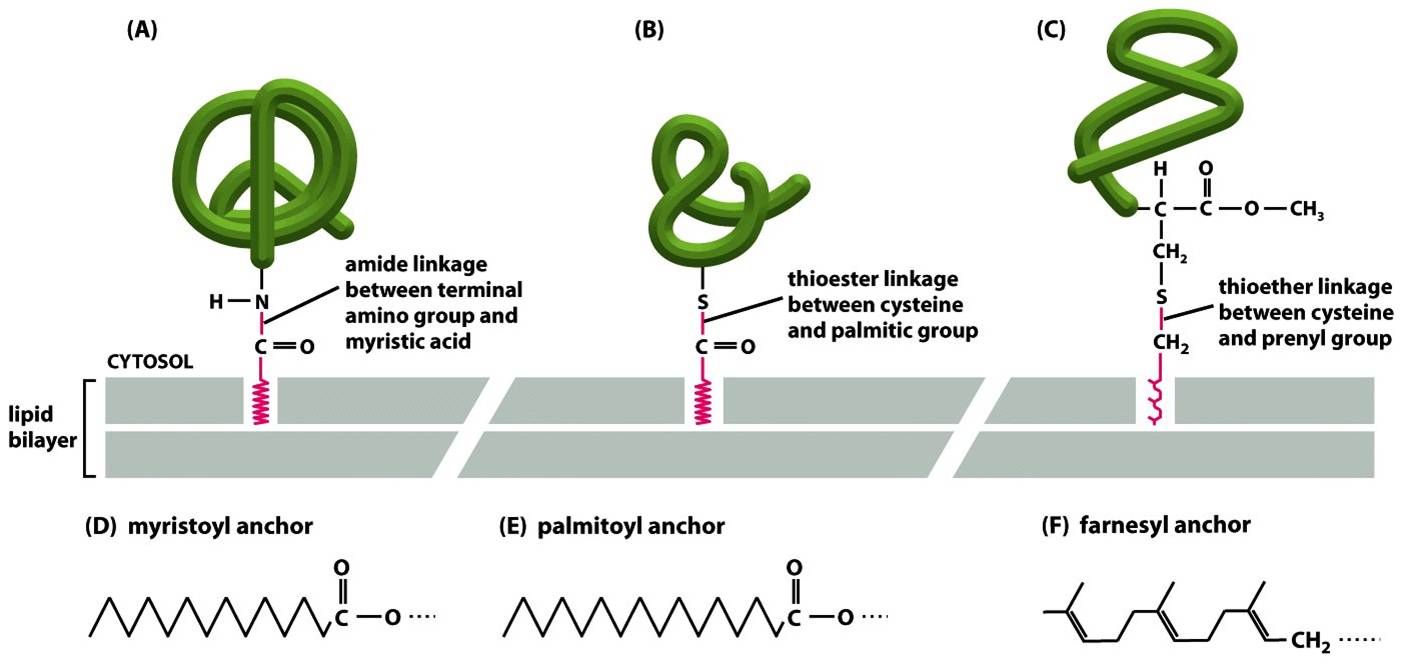
Membrana Plasmática
Figuras Legendadas
Imagens Complementares
Figura 1
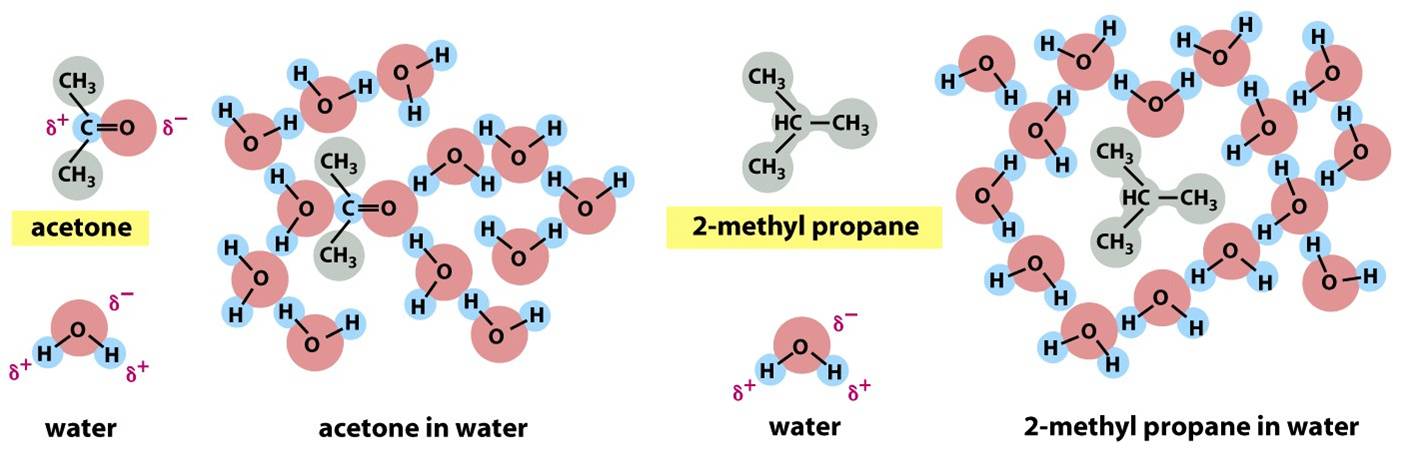
Figura 1: Interação entre a água e as moléculas hidrofóbicas e hidrofílicas
Ocorre, devido a natureza polar da acetona, a formação de interações eletrostáticas de forma favorável com as moléculas de água, que, por sua vez, são também polares. Dessa forma, é possível que a acetona dissolva-se de imediato quando em contato com a água. De maneira oposta, podemos ver que o 2-metil propano possui natureza totalmente hidrofóbica. Por esse motivo, ele não pode interagir favoravelmente com a água, algo que obriga que as moléculas adjacentes de água se reorganizem em estruturas que se assemelham ao gelo, fazendo com que a energia livre seja aumentada. Logo, o 2-metil propano é praticamente insolúvel em água. A carga parcialmente negativa está representada pelo símbolo δ-, e a positiva por δ+. Estão representados em cores os átomos polares e em cinza os grupos apolares.
Figura 2
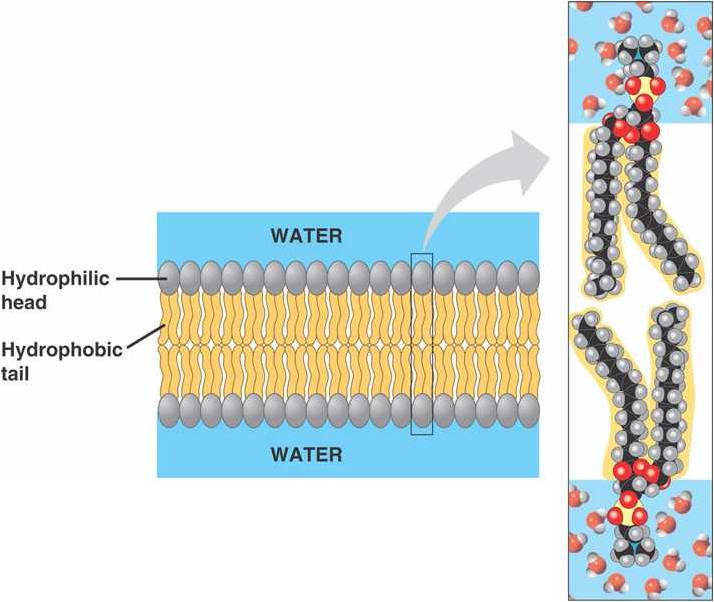
Figura 2: Bicamada fosfolipídica
A bicamada fosfolipídica é formada por fosfolipídeos, devido seu arranjo quando em interação com a água. As extremidades de tal camada são formadas pelas cabeças dos fosfolipídeos, e o centro por suas caudas. Isso se dá pela natureza anfipática dessas moléculas, onde a cabeça é hidrofólica, e, portanto, se encontra em contato com a água, enquanto as caudas são hidrofóbicas e encontram-se umas em contato com as outras. (A )A parte hidrofóbica está representada pela cor amarela, e a hidrofílica por cinza.
Figura 3
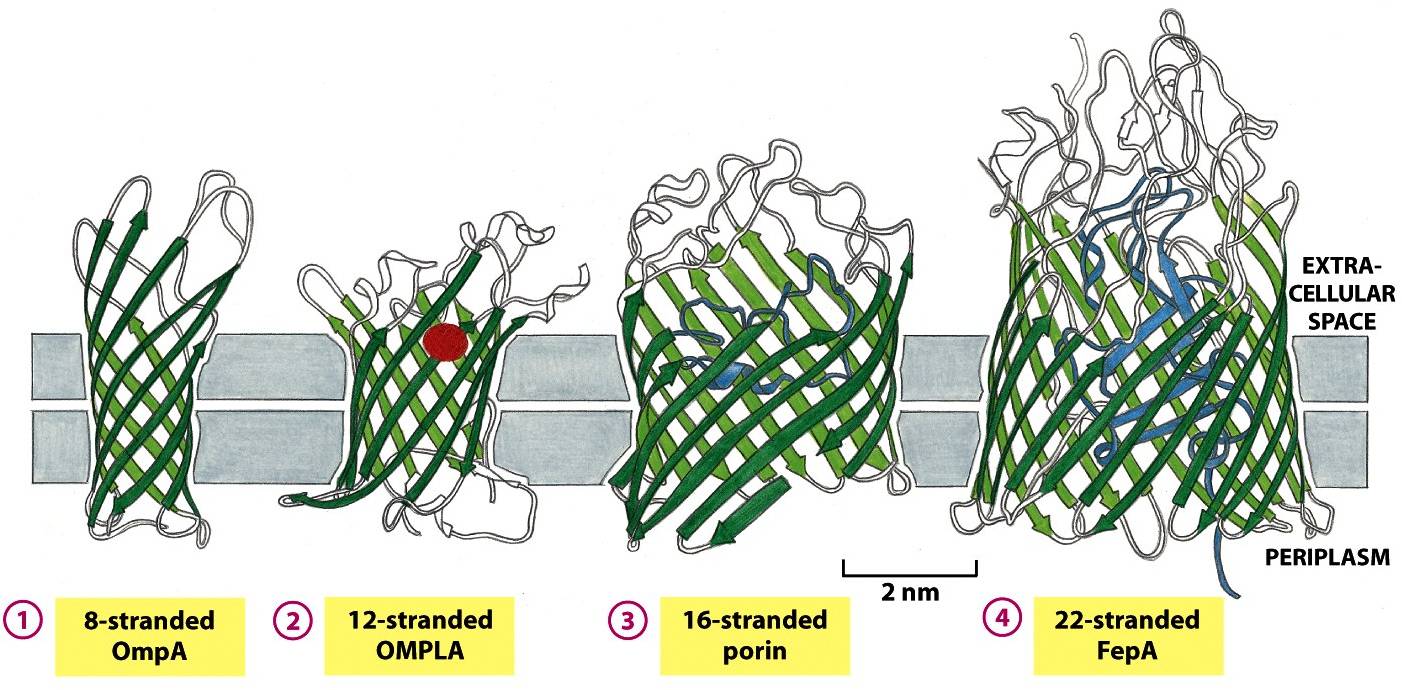
Figura 3: Barris β formados por diferentes números de fitas β
(1) Proteína OmpA de E. coli, a qual atua como um receptor para um vírus bacteriano. (2) Proteína OMPLA de E. coli, enzima (lipase) que atua realizando a hidrólise de moléculas de lipídeos. Nesse caso, existem aminoácidos (em vermelho) para catalisar a reação enzimática para o exterior d estrutura do barril. (3) Porina da bactéria Rhodobacter capsulatus, que forma um poro cheio de água por meio da membrana. As alças (em azul) posicionam-se para dentro do canal e causam a restrição do diâmetro deste. (4) Íons ferro contam com a proteína FepA para serem transportados. Em azul, temos um domínio de uma proteína globular preenchendo o barril, a qual possui o sítio onde ocorre a ligação do íon ferro (não mostrado). Ainda não são conhecidos os detalhes moleculares da reação em questão, mas crê-se que o domínio globular mude de conformação a fim de transportar o ferro ligado.
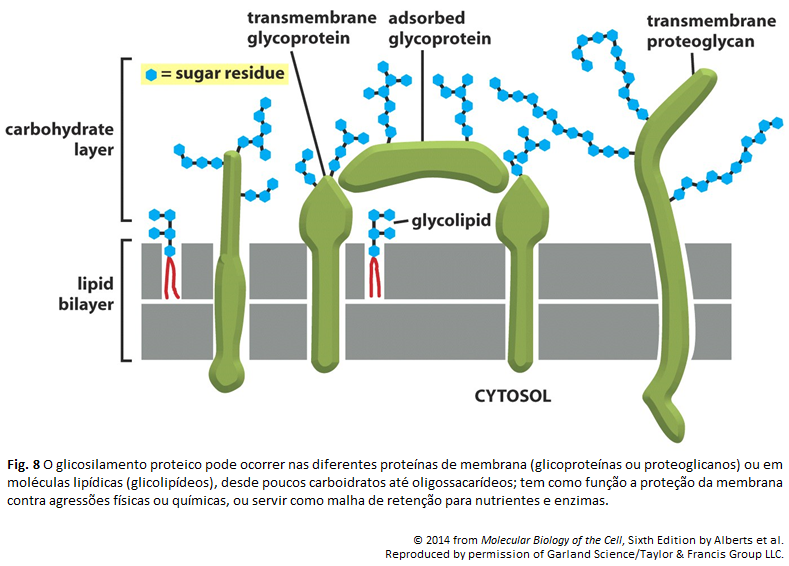
Figura 4
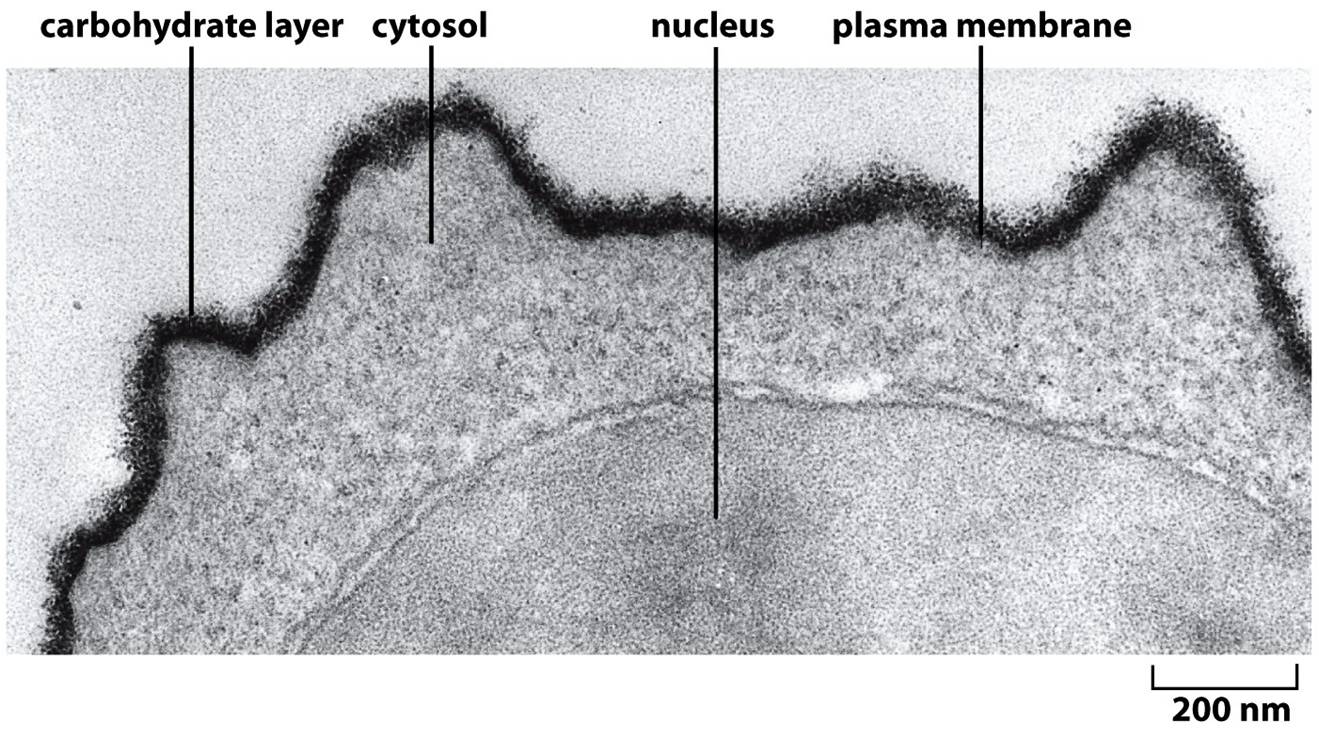
Figura 4: Camada de carboidrato da superfície celular
Micrografia eletrônica da superfície de um linfócito corado com vermelho de rutênio. O corante utilizado proporciona a visibilidade da espessa camada abundante em carboidrato e que também envolve a célula. A camada em questão é composta de cadeias laterais ricas em oligossacarídeos dos glicolipídeos e das glicoproteínas integrais da membrana. Também, proteoglicanos e glicoproteínas adsorvidos (não mostrados) ajudam a formar a camada de carboidratos em diversas células. Deve-se chamar atenção para o fato de todos os carboidratos estarem localizados na superfície não-citosólica da membrana.
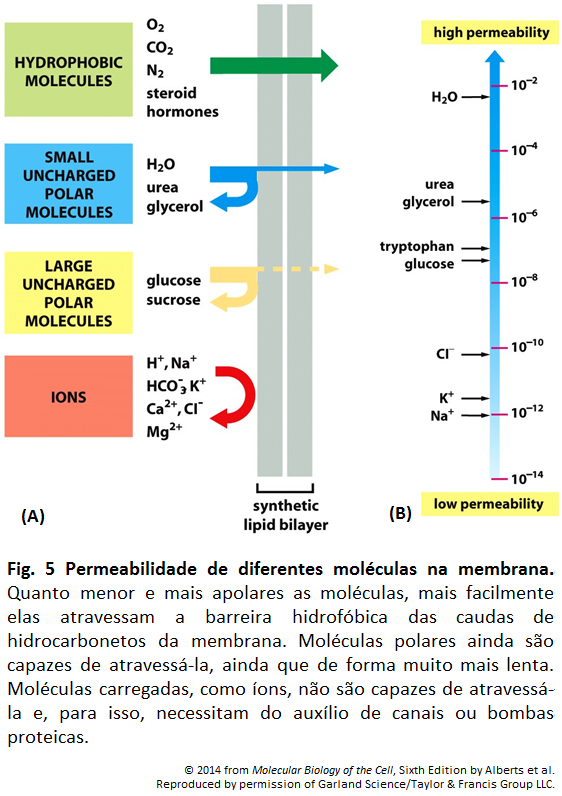
Figura 5
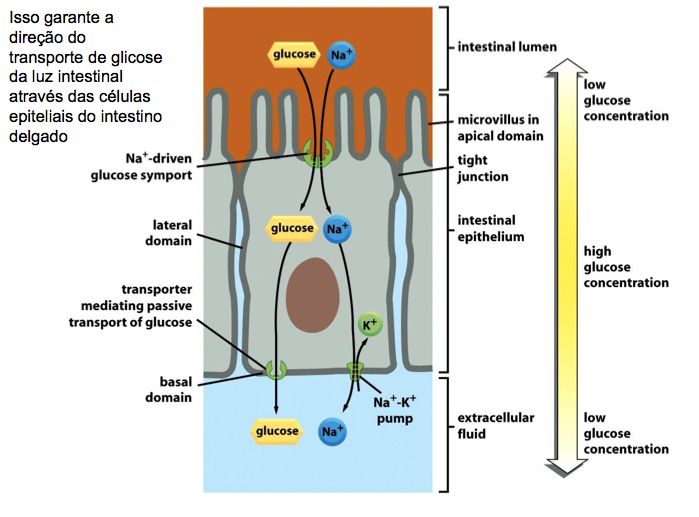
Figura 5: Transporte transcelular
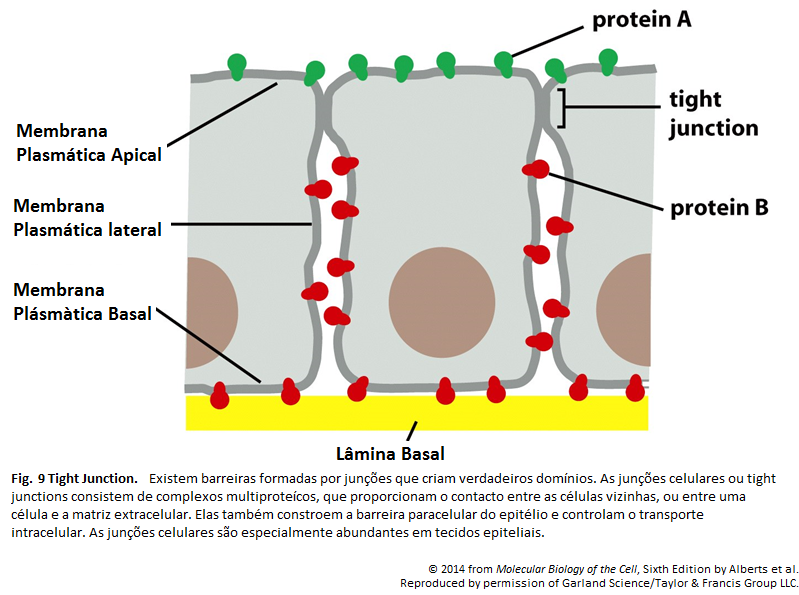
Para que ocorra o transporte transcelular de uma molécula de glicose por meio de uma célula epitelial intestinal, deve haver a disposição desigual de proteínas de transporte na membrana. A glicose é transportada do lúmen intestinal para o fluido extracelular (a partir de onde passa para a corrente sanguínea). Por meio do domínio apical da membrana por um simporte de glicose movido por Na+, a glicose é bombeada para a célula. Ela sai da célula (a favor de seu gradiente de concentração) por meio de transporte passivo mediado por uma proteína diferente transportadora de glicose nos domínios basal e lateral da membrana. Nesses domínios, há uma bomba de Na+ para manter a concentração interna de Na+ baixa, algo que dirige o simporte de glicose. Junções aderentes impermeáveis unem as células adjacentes. Tais junções têm dupla função no transporte transcelular de glicose: impedem que o soluto passe pelo epitélio entre as células, algo que mantém um gradiente de concentração de glicose através da camada de células, e também atuam como barreiras de difusão dentro da membrana celular, ajudando no confinamento das várias proteínas transportadoras aos seus correspondentes domínios na membrana.
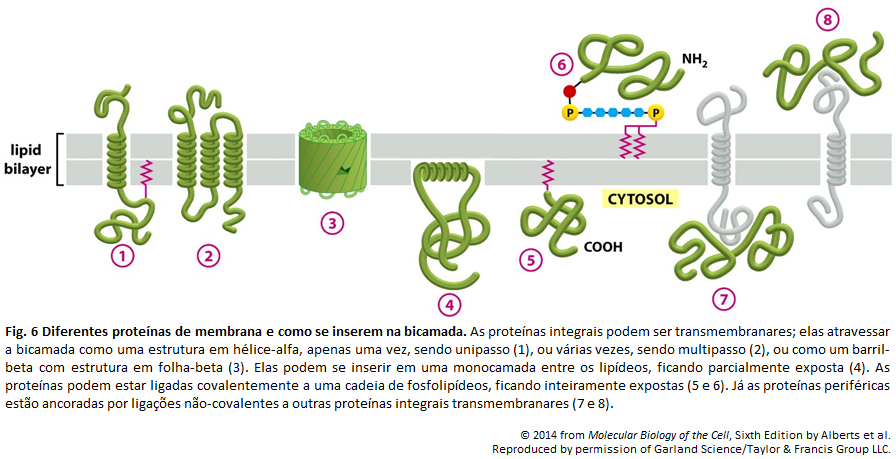
Figura 6
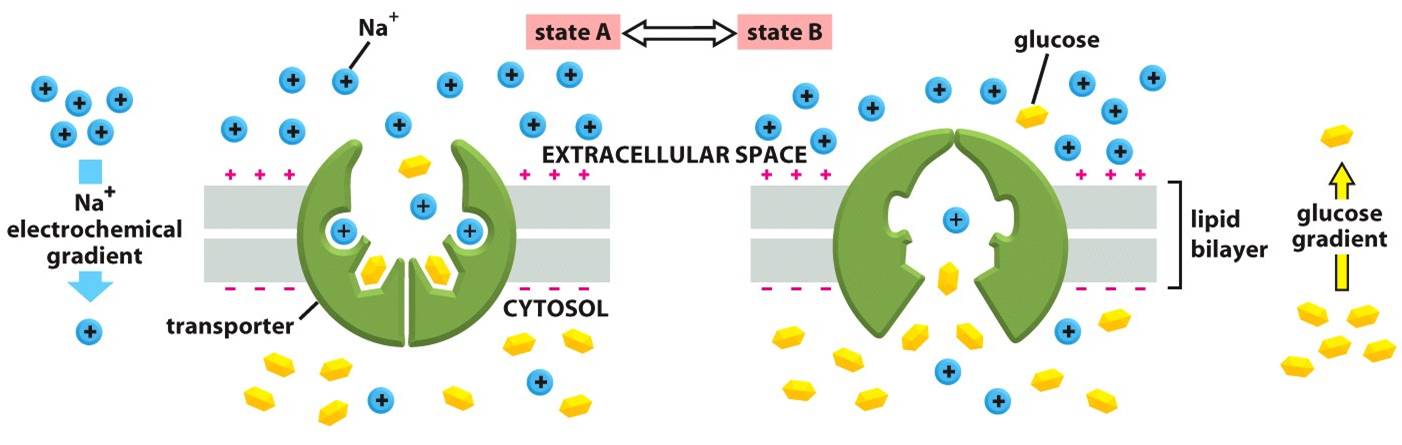
Figura 6: Uma maneira pela qual o transportador de glicose pode ser dirigido por um gradiente de Na+
Há dois estados alternados, A e B, entre os quais o transportador oscila. A proteína apresenta-se aberta para o meio extracelular quando no estado A, e para o meio intracelular quando no B. Vale lembrar que a ligação de Na+ e de glicose é cooperativa, ou seja, existe uma mudança conformacional que aumenta muito a afinidade da proteína pelo ligante apenas de há a prévia ligação de qualquer um dos ligantes. Sendo a concentração de Na+ muito maior no meio extrcelular que no intracelular, há maiores chances de a glicose se ligar ao transportador no estado A. Logo, é mais comum o Na+ e a glicose entrarem na célula (via uma transição A→B) do que serem removidos (via uma transição B→A). Mostra-se, como resultado, a entrada de Na+ e de glicose na célula. Também é necessário atentar-se ao fato de que a ligação é cooperativa, logo, caso haja a ausência de um dos solutos, é impossível que o outro se ligue ao transportador. Dessa forma, ocorre uma mudança conformacional no transportador, alternado ente os dois estados (A e B) somente se ambos os solutos, ou nenhum, estão ligados.
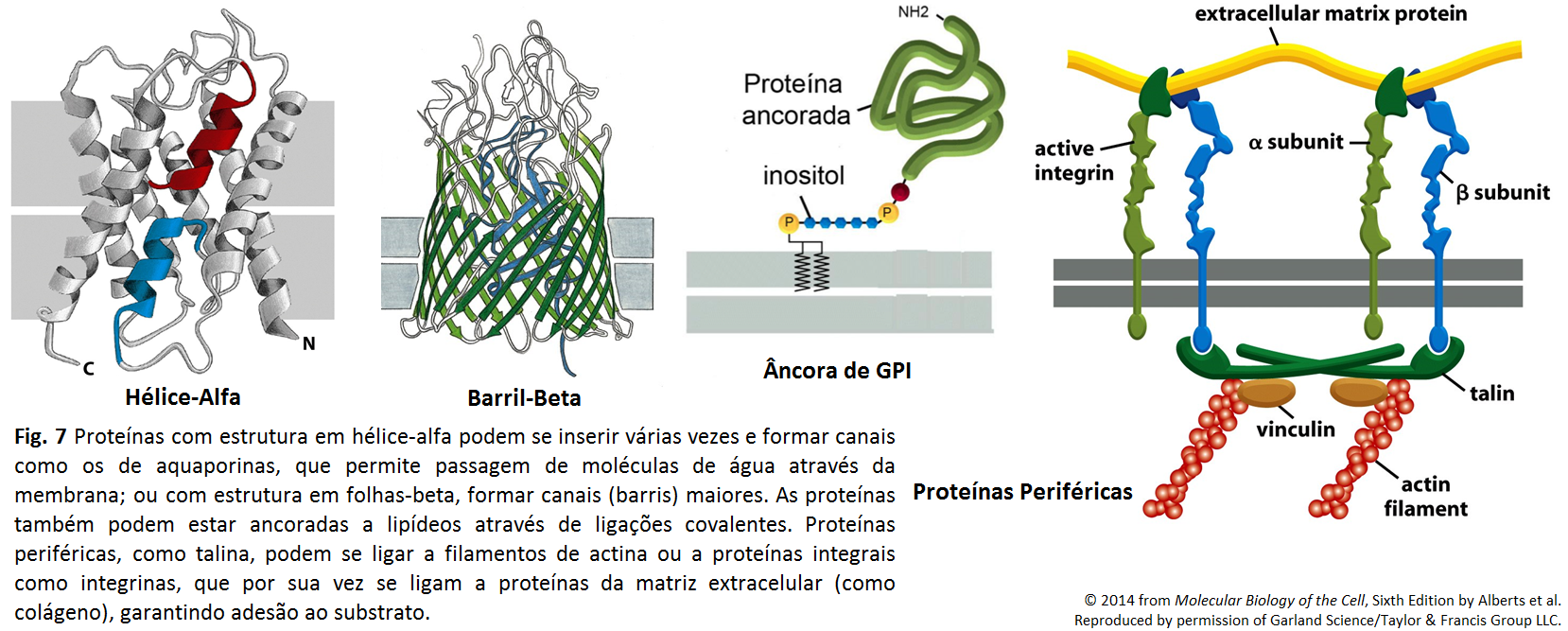
Figura 7
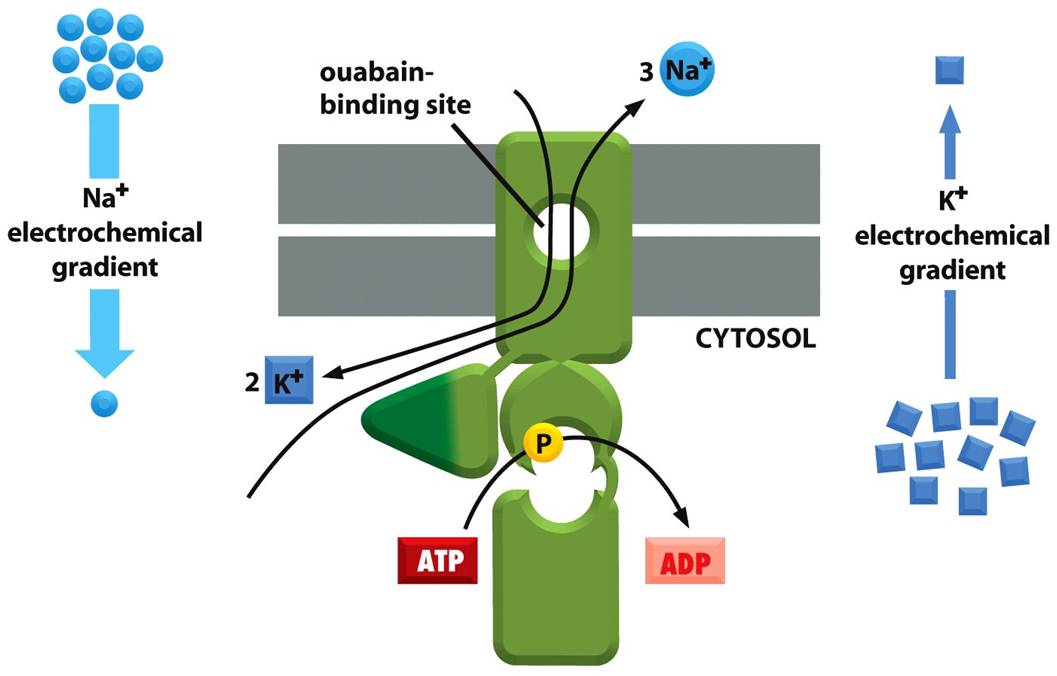
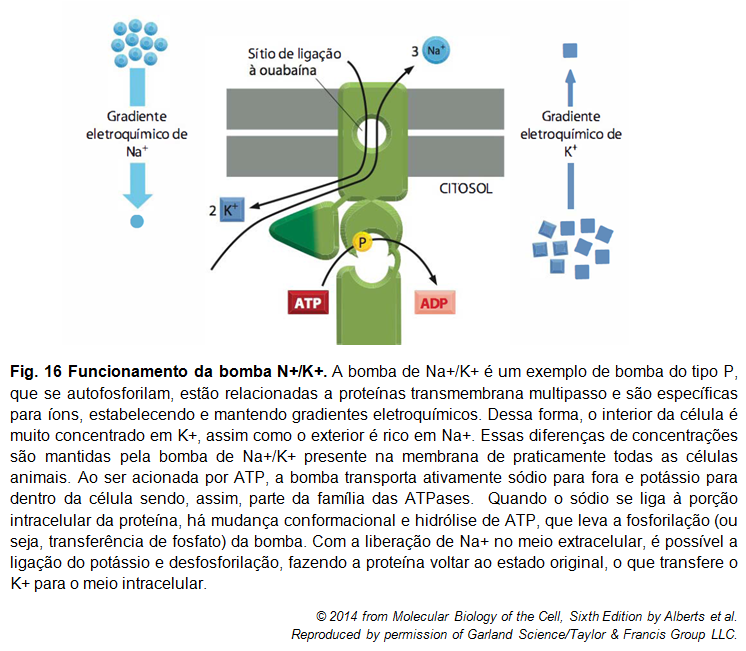
Figura 7: Bomba de Na+/K+
A bomba de Na+/K+ é uma proteína transportadora que bombeia Na+ para o meio extracelular e c para o meio intracelular, contra seus gradientes eletroquímicos. A célula hidrolisa uma molécula de ATP, e isso a leva ao bombeamento de três moléculas de Na+ para fora da célula, e de duas moléculas de K+ para dentro. Do lado extracelular da bomba, existe uma competição entre o inibidor específico ouabaína e o K+ pelo mesmo sítio. A presença desta bomba é essencial para que ocorra o funcionamento ideal da célula, bem como a manutenção de sua sobrevivência, já que garante a existência de uma diferença entre os meios intra e extracelular.
Todas as imagens foram retiradas da seguinte fonte (c) 2014 from Molecular Biology of the Cell, Sixth Edition by Alberts et al. Reproduced by permission of Garland Science/Taylor & Francis Group LLC.